这次三部委在周六傍晚突然出台的这份12号公告,是对以口罩为主的防疫物资出口祭出的最为严格的措施!那么这到底会对防疫物资出口造成怎样的影响呢?就让我们一起来看看吧。
针对商务部12号公告,大家最关心的主要问题有:
1.非医用口罩仅符合国内质量标准,但不在商务部白名单中,能否正常出口?
2.非医用口罩同时符合国内和国外质量标准,但不在商务部白名单中,能否正常出口?
3.医用口罩等医用物资符合中国医用质量标准,但不在商务部白名单,能否正常出口?
4.商务部5号公告和12号公告是冲突还是关联的关系?
1.非医用口罩仅符合国内质量标准,但不在商务部白名单中,能否正常出口?
2.非医用口罩同时符合国内和国外质量标准,但不在商务部白名单中,能否正常出口?
3.医用口罩等医用物资符合中国医用质量标准,但不在商务部白名单,能否正常出口?
4.商务部5号公告和12号公告是冲突还是关联的关系?
第一部分:非医用口罩
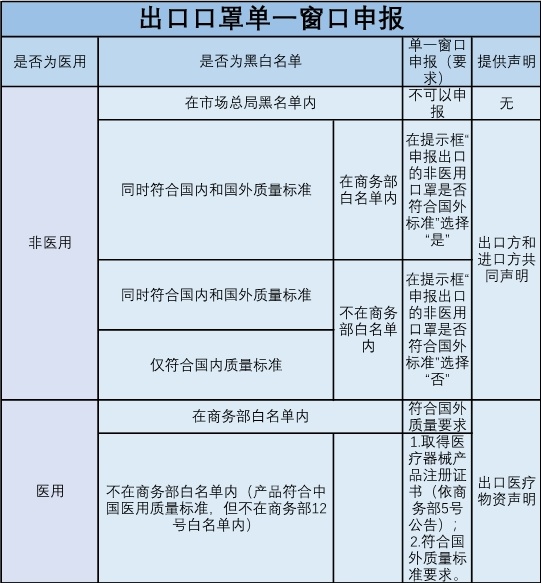
1.非医用口罩出口实行白黑名单管理,商务部提供白名单,市场监管总局提供黑名单。符合国外质量标准看商务部白名单(需在名单内);国内质量标准看市场监管总局黑名单(需不在名单内)。
换句话说就是非医用口罩只要在黑名单内的就不可以申报。
不在黑名单也不在白名单的,只要产品符合我国质量标准的也可以正常申报,申报时多提供一个双方共同声明就行。
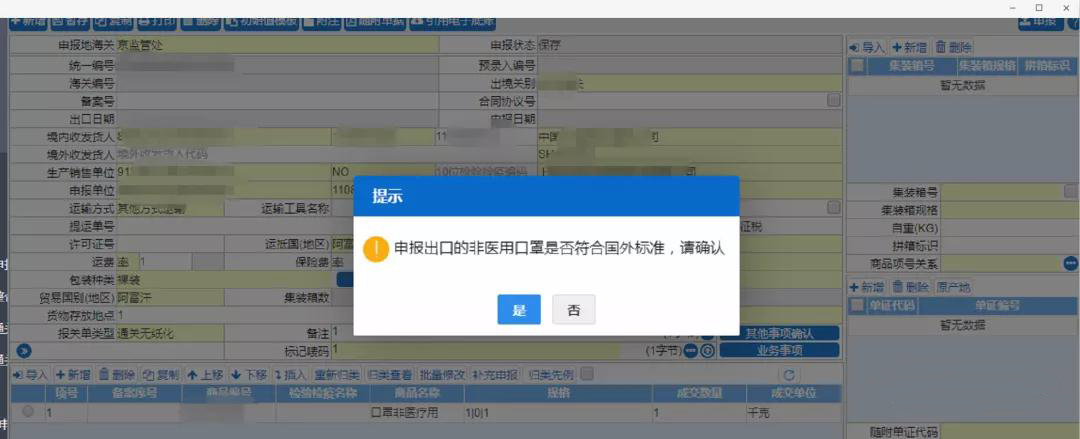
2.目前,单一窗口系统已更新,填报时,在出口报关单的“生产销售单位”栏目填写实际生产口罩企业名称及代码(不填销售企业),并点击是否符合国外标准,此时,单一窗口系统会将申报的生产企业名单与商务部提供的白名单进行核碰,核碰上的,则自动受理申报。

商务部12号公告,自4月26日起,产品取得商务部白名单的新冠病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的出口企业,海关凭商务部白名单验放(企业提供出口医疗物质声明,可免提交医疗器械产品注册证)。
不在商务部12号公告白名单内但产品符合中国医用质量标准的,按照商务部5号公告执行,企业需取得医疗器械产品注册证书,并提供出口医疗物资声明承诺符合国外质量标准要求。
温馨提示:
如果是4月1日(含)以后签订合同且出口产品未取得医疗器械产品注册证书的生产企业,但是符合国外质量标准要求,生产企业可向当地商务局申请加入商务部白名单。
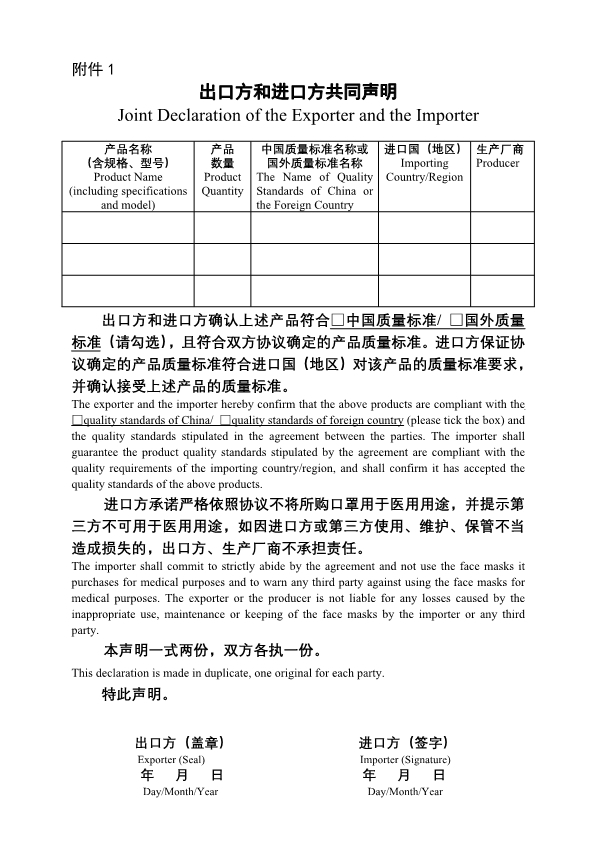
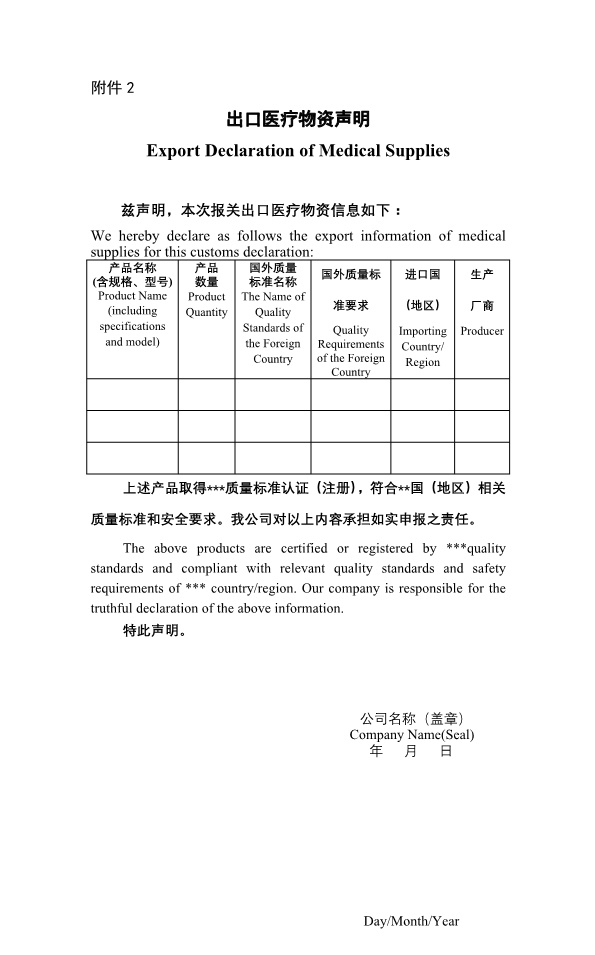
从公告中提到的《国外标准认证或注册的非医用口罩生产企业清单》来看,非医用口罩也必须取得进口国官方的注册和企业准入,这将进一步提高对非医用口罩的监管要求,而这个要求则符合小伙伴们在之前的猜测,即对出口产品的监管责任主要在于进口国,只要进口国认可了产品或生产企业,中国海关没必要再做限制性措施。
特别提醒:在公告中有一个特殊的措辞 “对4月26日之前已签订的采购合同” ,对于这个合同签署节点确认的有点问题,目前海关应该是无法确定的,所以可能会以是否已经申报作为标志进行一刀切的判断。
最后为方便各位理解,一图流送上!
非医用口罩生产企业白名单地址(动态更新):
http://www.cccmhpie.org.cn/Pub/6325/176185.shtml
医疗物资生产企业白名单地址(动态更新):http://www.cccmhpie.org.cn/Pub/6325/176181.shtml
非医用口罩生产企业黑名单地址(动态更新):www.samr.gov.cn






