FDA随即于5月7日撤回了中国60多家制造商向美国出口N95型口罩的紧急使用授权(EUA)。
美国食品药品管理局FDA在7号表示,已将中国获准为美国生产N95口罩的制造商数量从大约80家减少到14家。这推翻了其4月3日做出的一项决定,即允许那些没有经过美国当局检测的制造商生产的口罩进口到美国,只要它们符合其他一些国家设定的标准,或者经过一家独立实验室的审查。
美国国家职业安全卫生研究所Niosh测试发现,周四被取消出口资格的一家中国公司的口罩只过滤了24%-35%的颗粒物,远低于N95口罩命名所要求的过滤95%颗粒物的标准。根据Niosh的测试结果,该口罩的包装宣称其过滤级别为五星级,并使用了未经授权的FDA标志。还有一个品牌只能过滤1%颗粒物,而其他品牌则远远低于95%的阈值。
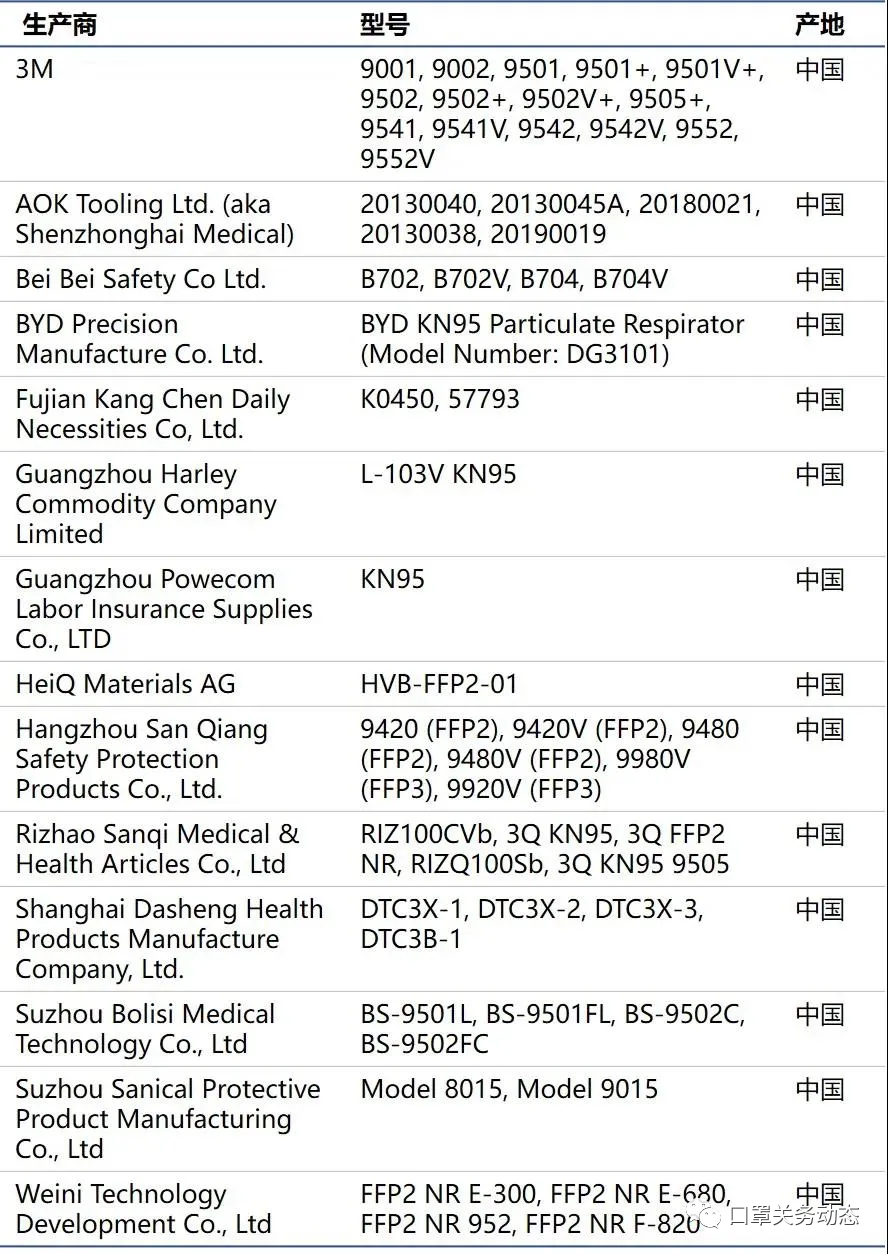
(剩余14家在榜的厂家)
为解决对不合格产品的质疑和担忧,美国 FDA 对其于 2020 年 4 月 3 日发布的旨在针对中国生产非 NIOSH 授权呼吸器的 EUA(紧急临时授权)(附录 A)的符合性准则做了修订,并为目前已存在于附录A,但即将被删除制造商提供了一个解决方案。修订后的 EUA(紧急临时授权)自2020 年 5月 7 日起生效。
颁发授权的新准则
中国生产的符合以下准则之一的一次性非NIOSH批准的呼吸器,符合5月7日修订的EUA授权:
1:呼吸器由持有一个或多个 NIOSH 批准的其他 FFRs型号的实体制造,这些型号是按照FDA 可验证的其他国家/地区适用的授权标准生产的;
2:通过了其他国家的认证,包括中国国家医药产品管理局(NMPA)注册认证,并且可以提供相应的能经FDA验证的证据;
3:对于曾经被添加到基于2020年4月3日授权的附录A 的呼吸器,需要在此修订版本 EUA 发布之日起45 日内提交 NIOSH 按照其修订版的标准测试规程(STP) TEBAPR‐STP‐0059 的评估,即最小最大过滤率均等于或大于95%。
符合如上任何一项新授权准则的呼吸器在 FDA 确认相关资质文件符合要求后会作为授权呼吸器添加到附录 A中。

FDA现在仅允许从已在美国或中国以外的某些地区(包括欧盟在内)获得认证的制造商进口产品。
美国政府其他部门也正在努力打击大量假冒口罩,美国移民与海关执法局正在与3M和亚马逊等公司合作,以减少低质量产品的进口。






